SISTEMUL DE STOCARE A ENERGIEI
Bateria reprezintă una din cele mai folosite surse de energie electrică încă de la inventarea pilei electrice, în anul 1800, de către fizicianul italian Alessandro Volta 1
Componentele unei baterii
O baterie electrochimică este realizată dintr-un element de bază sau mai multe iar acestea din urmă sunt grupate în conexiuni serie-paralel 2.
Un element este alcătuit, în principal, din trei elemente:
- Electrodul negativ sau anodul – electrodul reducător sau donor – acesta cedează electroni către circuitul extern și la care are loc oxidarea în timpul reacției electrochimice;
- Electrodul pozitiv sau catodul – electrodul oxidant – acesta acceptă electroni de la circuitul extern și la care are loc procesul de reducere în timpul reacției electrochimice;
- Electrolitul – mediul ce conduce ionii – este mediul în care are loc transferul de energie, ca ioni, în interiorul elementului, între anod și catod. Un electrolit este de obicei un lichid ca de exemplu apa sau alți solvenți, în care sunt dizolvate săruri, acizi sau alcaline. Sunt și elemente ce au în structură electrolit solid și care prezintă conducție ionică la temperatura de funcționare a celulei.
Ca anod și catod se folosesc combinații dintre materialele cele mai ușoare și care oferă o tensiune și o capacitate cât mai ridicată celulei. Astfel de combinații nu sunt întotdeauna și practice din cauza reactivității lor cu alte elemente ale celulei, dificultății de manipulare, prezintă costuri ridicate, etc..
Într-un sistem practic, anodul este ales ținând cont de următoarele proprietăți:
- Să fie eficiente ca agent reducător;
- Randament ridicat [\(Ah/g\)];
- Stabilitate;
- Ușurință în fabricare;
- Preț de cost scăzut.
Din tabelul de mai jos rezultă că hidrogenul (\(H_2\)) este atractiv ca material anodic dar având în vedere că este greu de manipulat și periculos nu prea a fost folosit în practică. Practic metalele sunt cele folosite ca și material pentru anod, iar pentru acesta zincul (\(Zn\)) a fost folosit ca și material predominant deoarece prezintă proprietăți adecvate. Mai nou este folosit litiu (\(Li\)) deoarece prezintă o greutate scăzută și un înalt randament [\(Ah/g\)] și pentru care s-au dezvoltat electroliți ce permit folosirea acestuia într-o oarecare siguranță 2.
Tabelul 1. Caracteristicile materialelor folosite pentru Anod2
| Material | Masa moleculară | Potențialul standard de reducere, la \(25^0C\) | Valența | Punctul de topire | Densitatea | Echivalențe electrochimice | ||
|---|---|---|---|---|---|---|---|---|
| [\(g\)] | [\(V\)] | [\(^0C\)] | [\(g/cm^3\)] | [\(Ah/g\)] | [\(g/Ah\)] | [\(Ah/cm^3\)] | ||
| \(H_2\) | 2,01 | 0; *-0,83 | 2 | - | - | 26,59 | 0,037 | |
| \(Li\) | 6,94 | -3,01 | 1 | 180 | 0,54 | 3,86 | 0,259 | 2,06 |
| \(Na\) | 23,0 | -2,71 | 1 | 98 | 0,97 | 1,16 | 0,858 | 1,14 |
| \(Mg\) | 24,3 | -2,38; *-2,68 | 2 | 650 | 1,74 | 2,20 | 0,454 | 3,8 |
| \(Al\) | 26,9 | -1,66 | 3 | 659 | 2,69 | 2,98 | 0,335 | 8,1 |
| \(Ca\) | 40,1 | -2,84; *-2,35 | 2 | 851 | 1,54 | 1,34 | 0,748 | 2,06 |
| \(Fe\) | 55,8 | -0,44; *-0,88 | 2 | 1528 | 7,85 | 0,96 | 1,04 | 7,5 |
| \(Zn\) | 65,4 | -0,76; *-1,25 | 2 | 419 | 7,14 | 0,82 | 1,22 | 5,8 |
| \(Cd\) | 112,4 | -0,40; *-0,81 | 2 | 321 | 8,65 | 0,48 | 2,10 | 4,1 |
| \(Pb\) | 207,2 | 0,13 | 2 | 327 | 11,34 | 0,26 | 3,87 | 2,9 |
Tabelul 2. Caracteristicile materialelor folosite pentru Catod2
| Material | Masa moleculară | Potențialul standard de reducere, la \(25^0C\) | Valența | Punctul de topire | Densitatea | Echivalențe electrochimice | ||
|---|---|---|---|---|---|---|---|---|
| [\(g\)] | [\(V\)] | [\(^0C\)] | [\(g/cm^3\)] | [\(Ah/g\)] | [\(g/Ah\)] | [\(Ah/cm^3\)] | ||
| \(O_2\) | 32,0 | 1,23; *0,40 | 4 | - | - | 3,35 | 0,30 | |
| \(Cl_2\) | 71,0 | 1,36 | 2 | - | - | 0,756 | 1,32 | |
| \(SO_2\) | 64,0 | - | 1 | - | - | 0,419 | 2,38 | |
| \(MnO_2\) | 86,9 | 1,28 | 1 | - | 5,0 | 0,308 | 3,24 | 1,54 |
| \(NiOOH\) | 91,7 | *0,49 | 1 | - | 7,4 | 0,292 | 3,42 | 2,16 |
| \(CuCl\) | 99,0 | 0,14 | 1 | - | 3,5 | 0,270 | 3,69 | 0,95 |
| \(FeS_2\) | 119,9 | - | 4 | - | - | 0,89 | 1,12 | 4,35 |
| \(AgO\) | 123,8 | *0,57 | 2 | - | 7,4 | 0,432 | 2,31 | 3,2 |
| \(Br_2\) | 159,8 | 1,07 | 2 | - | - | 0,335 | 2,98 | |
| \(HgO\) | 216,6 | *0,10 | 2 | - | 11,1 | 0,247 | 4,05 | 2,74 |
| \(Ag_2O\) | 231,7 | *0,35 | 2 | - | 7,1 | 0,231 | 4,33 | 1,64 |
| \(PbO_2\) | 239,2 | 1,69 | 2 | - | 9,4 | 0,224 | 4,45 | 2,11 |
| \(I_2\) | 253,8 | 0,54 | 2 | - | 4,94 | 0,211 | 4,73 | 1,04 |
*Electrolit bazic, restul de date sunt pentru electrolit acid
Clasificarea bateriilor
Bateriile electrochimice, în principal, sunt împărțite în două categorii2:
- Baterii primare, la care procesul electrochimic este ireversibil, acestea fiind de unică folosință, așa cum era și pila electrică a lui Alessandro Volta. Acestea sunt întâlnite, în general, sub denumirea simplă de baterii;
- Baterii secundare, la care procesul electrochimic este reversibil, acestea putând fi refolosite prin reîncărcare, apărută în anul 1836, sub denumirea de pila lui Daniell, iar acesta fiind inventată de către chimistul și meteorologul de origine britanică John Frederic Daniell3. Acestea sunt întâlnite, în general, sub denumirea de baterii de acumulare sau mai simplu de acumulatori;
- Baterii de rezervă, la acest tip de baterii procesul electrochimic nu este demarat ca urmare a izolării unuia dintre cele trei elemente ce alcătuiesc bateria: electrodul pozitiv (catodul), electrodul negativ (anodul) și electrolitul. De obicei la acest tip baterii electrolitul este cel ce este izolat, iar ca materiale în producerea electrolitului este folosită apa sau apa de mare. Sunt folosite în aplicații unde dispozitivele/echipamentele sunt aflate în așteptare iar atunci când este necesar acest tip de baterie este activată și este în stare a furnizare curenți mari în timp scurt. Sunt folosite în domeniul apărării: la rachete, torpile, etc 4.
Există și baterii de acumulare la care energia electrică de curent continuu nu este transformată prin procese electrochimice în vederea depozitării. La aceste baterii de acumulare energia electrică de curent continuu este depozitată sub formă sarcină electrică, cum este cazul bateriilor de condensatoare. Acestea au început a fi folosite odată cu dezvoltarea tehnologică ce a permis realizarea de condensatoare de ordinul farazilor 5.
Funcționarea unui element
În figurile de mai jos sunt prezentate procesele electrochimice la descărcare respectiv încărcare din cadrul unei celule2.
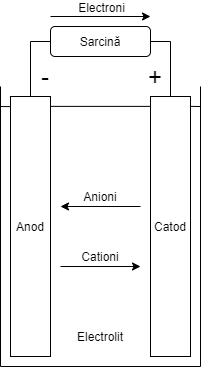 |
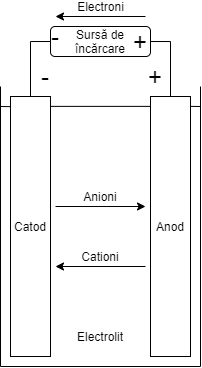 |
|---|---|
| Figura 1. Celula procesul de descărcare | Figura 2. Celula procesul de încărcare |
Descărcarea unui element
În Figura 1, este prezentat schematic procesul de descărcare. Acest proces apare când un element sau o baterie este conectată la un circuit extern, pe o sarcină externă, și în timpul căruia electronii se vor deplasa de la anod către catod prin sarcina externă. La anod se va instala procesul de oxidare și de cedare de electroni ce vor fi acceptați de către catod unde se va instala procesul de reducere. În interiorul electrolitului se va stabili un flux de anioni (ioni negativi) către anod și un flux de cationi (ioni pozitivi) către catod2.
Din punct de vedere electrochimic reacția de descărcare poate fi scrisă, presupunând un metal ca material anodic, de exemplu zincul (\(Zn\)) și un material catod, cum ar fi clorul (\(Cl_2\)), după cum urmează:
La electrodul negativ avem reacție anodică (de oxidare, de pierderea electronilor):
\[ Zn \longrightarrow Zn ^{2+}+2e\]
La electrodul pozitiv avem reacție catodică (de reducere, de câștig de electroni):
\[ Cl_2+2e \longrightarrow 2Cl^-\]
Reacția totală, în cazul descărcării, se obține prin însumarea celor două reacții de la anod și respectiv catod, obținând:
\[ Zn + Cl_2 \longrightarrow Zn ^{2+} +2 Cl ^- (ZnCl_2)\]
Încărcarea unui element
În Figura 2, este prezentat schematic procesul de încărcare. În timpul acestui proces aplicat unui element reîncărcabile sau baterii secundare, sensul de circulație a curentului este inversat și ca urmare oxidarea va avea loc la electrodul pozitiv și reducerea la electrodul negativ. Întrucât anodul este, prin definiție, electrodul la care are loc oxidarea și catodul cel în care are loc reducerea, electrodul pozitiv este acum anodul și negativ catodul 2.
În cazul elementului \(Zn – Cl_2\), anterior descris , reacția la încărcare poate fi scrisă astfel:
-
La electrodul negativ avem reacție catodică (de reducere, de câștig de electroni):
\[ Zn^{2+}+2e \longrightarrow Zn\]
-
La electrod pozitiv avem reacție anodică (de oxidare, de pierderea electronilor):
\[ 2Cl^- \longrightarrow Cl_2+2e\]
Reacția totală, în cazul încărcării, se obține prin însumarea celor două reacții de la anod și respectiv catod, obținând:
\[ Zn^{2+}+2Cl^- \longrightarrow Zn+Cl_2\]
Tensiunea, capacitatea și energia teoretică a unui element
Aceste trei mărimi fizice: tensiunea, capacitatea și energia, sunt determinate în primul rând de materialele ce alcătuiesc în principal cele trei componente, respectiv anod, catod și electrolit, aferente unui element. Prin combinații ale materialelor folosite pentru anod, Tabelul 1, respectiv catod, Tabelul 2, se pot obține baterii sau elemente de baterii cu următoarele caracteristici.
Tabelul 3. Tensiunea, capacitatea și energia Bateriilor primare - Valori teoretice și practice2
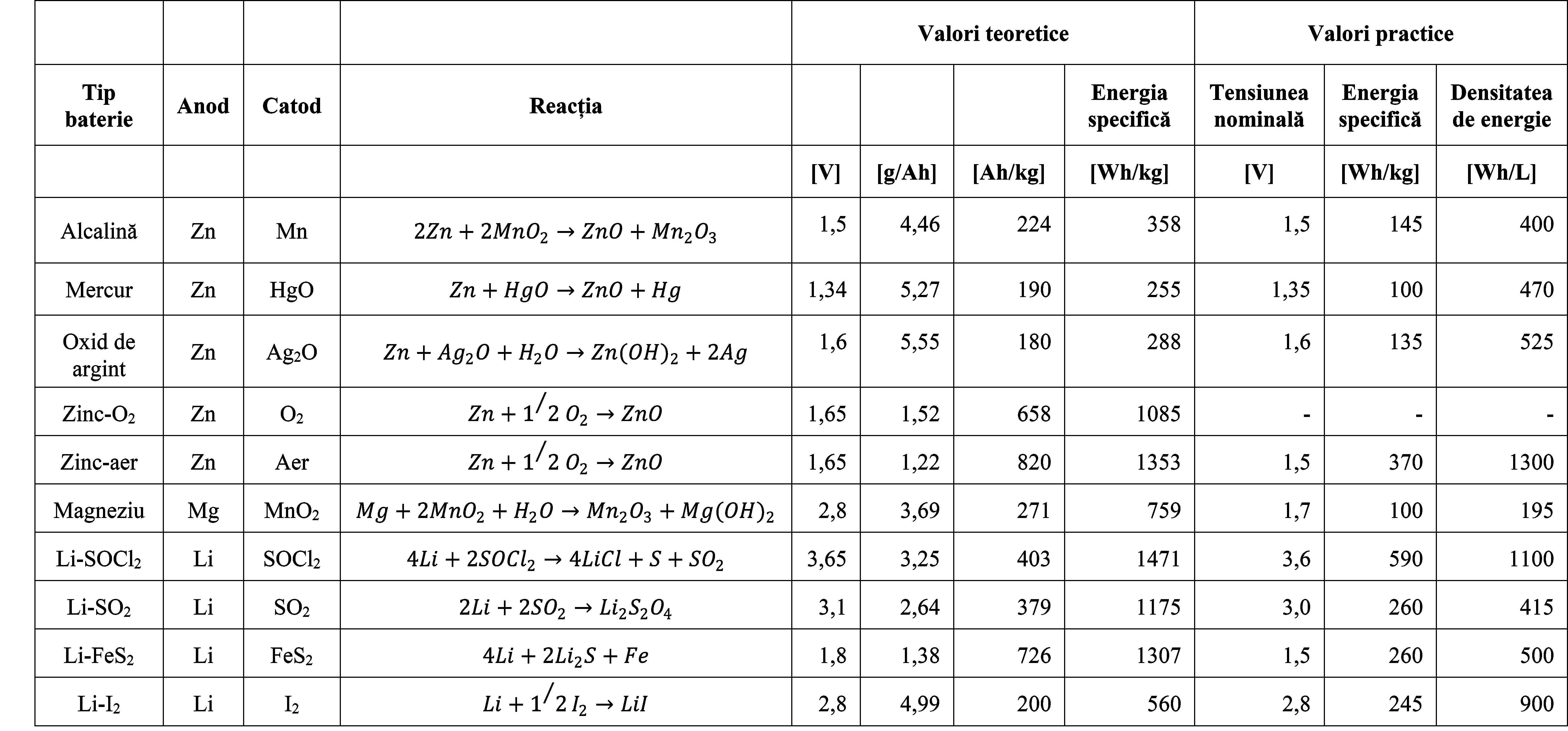
Tabelul 4. Tensiunea, capacitatea și energia Bateriilor secundare - Valori teoretice și practice2
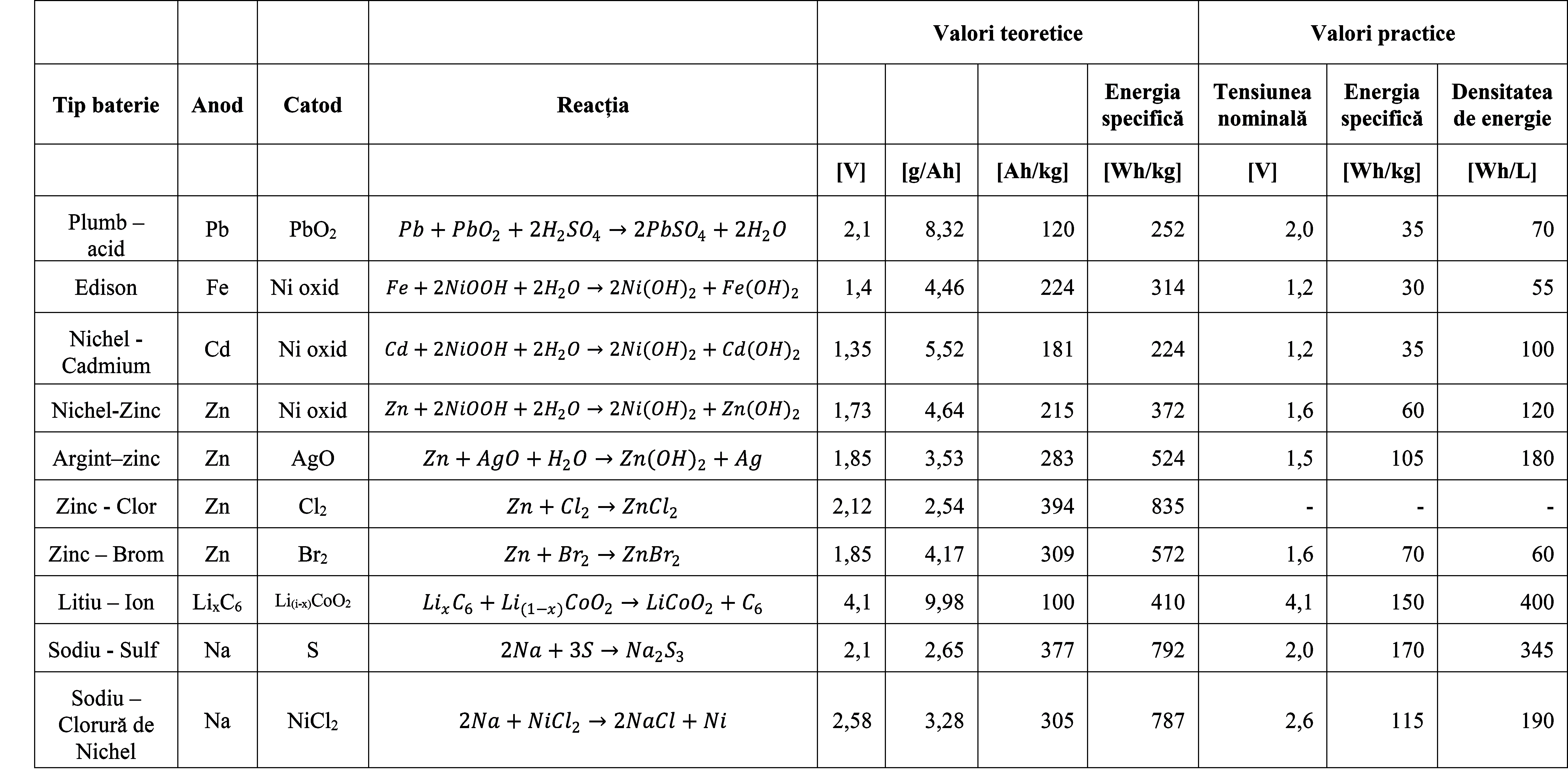
Energia liberă
Ori de câte ori are loc o reacție, energia liberă a sistemului va fi cedată, acesta se exprimată ca:
\[ \Delta G^0=-nFE^0\]
, unde:
\(F\) – reprezintă constanta lui Faraday (96.500 [C] sau 26,8 [Ah]);
\(n\) – reprezintă numărul de electroni implicați în reacție;
\(E^0\) – reprezintă potențialul/tensiunea standard, în [V].
Tensiunea teoretică
Această mărime a unui element se determină în funcție de tipurile de materiale ce alcătuiesc respectivul element. Poate fi determinată din energia liberă sau poate fi obținută experimental. În Tabelul 1 și Tabelul 2 sunt indicate la câteva materiale ce pot fi folosite pentru electrozi cu potențialul/tensiunea de electrod aferentă2.
Tensiunea teoretică standard a unui element poate fi calculată din potențialele standard ale electrozilor astfel:
Anod (tensiunea de oxidare) + Catod (tensiunea de reducere) = Tensiunea teoretică standard
De exemplu, în cazul reacției:
\[ Zn+Cl_2 \longrightarrow ZnCl_2\]
se va obține tensiunea teoretică standard, astfel:
| \(Zn \longrightarrow Zn^{2+}+2e\) | \(-(-0,76 [V])\) |
|---|---|
| \(Cl_2 \longrightarrow 2Cl^--2e\) | \(1,36 [V]\) |
| . | \(E^0=2,12 [V]\) |
Capacitatea teoretică
Capacitatea teoretică a unui element este direct proporțională cu, cantitatea de material activ din element ce alcătuiește electrozii. Capacitatea este definită în coulombi \([C]\) sau în amperi-oră \([Ah]\). Cel mai adesea se folosește \([Ah]\), unde \(1 [Ah] = 3.600 [C]\). Teoretic o greutate echivalentă de 1 gram de material va furniza \(96,487 [C]\) sau \(26,8 [Ah]\). Capacitatea teoretică este obținută din Legea lui Faraday a electrolizei 6:
\[ q = {{z \cdot F} \over M} \]
, unde:
\(q\) – reprezintă capacitatea teoretică, \([Ah/g]\);
\(z\) – reprezintă numărul de valență a ionilor substanței (electroni transferați per ion);
\(F\) – reprezintă constanta lui Faraday (\(96.500 [C]\) sau \(26,8 [Ah]\));
\(M\) – masa molară a substanței (materialului), în [g/mol].
De asemenea acesta se poate obține din echivalența electrochimică a materialelor tipice ce alcătuiesc elementul iar acestea sunt date tabelar, de exemplu în Tabelul 1 și Tabelul 2 sunt listate câteva materiale cu datele aferente.
Capacitatea teoretică a unei celule electrochimice, bazată doar pe materialele active care participă la reacția electrochimică, este calculată din greutatea echivalentă a reactanților. De exemplu capacitatea teoretică a celulei \(Zn-Cl_2\) este \(0,394 [Ah/g]\), și se obține astfel:
Pentru reacția:
\[ Zn+Cl_2 \longrightarrow ZnCl_2\]
Din Tabelul 1 și Tabelul 2 scoatem echivalențele electrochimice a \(Zn\) și al \(Cl_2\) și se obține:
\[ 1,22 [g/Ah] + 1,32 [g/Ah] = 2,54 [g/Ah] \; sau \; 0,393 [Ah/g]\]
sau cu ajutorul ecuației anterioare, a capacității teoretice, obținută din Legea lui Faraday:
\[ q = {{z \cdot F} \over {M}} = {{2 \cdot 26,8 [Ah][mol^{-1}]} \over {M(Zn)[g][mol^{-1}] + M(Cl_2) [g][mol^{-1}]}} = {{53,6[Ah]} \over {(65,4+71)[g]}} = {{53,6[Ah]} \over {136,4[g]}} = 0,393 {[Ah] \over [g]}\]
Valorile teoretice de mai sus au fost obținute numai ținând cont de materialul folosit la anod și catod iar electrolitul sau oricare alt material a fost omis. De exemplu în cazul bateriei plumb-acid, pentru reacția:
\[ Pb+PbO_2+2H_2SO_4 \longrightarrow 2PbSO_4+2H_2O \]
Dacă ținem cont și de electrolit vom obține capacitatea teoretică de:
\[ q = {{z \cdot F} \over {(M(Pb)+M(PbO_2)+2M(H_2SO_4)}}={{2\cdot26,8[Ah][mol^{-1}]} \over {(207+239+2\cdot98) [g][mol^{-1}]}}={{53,6} \over {642}} {{[Ah]} \over {[g]}}=0,0835 {{[Ah]}\over{[g]}}=83,5 {{[Ah]} \over {[kg]}} \]
iar acesta este mult mai mică ca cea din Tabelul 4 unde autorii2 au ținut cont numai de masa catodului și anodului obținând astfel \(120 [Ah/kg]\).
Energia teoretică
Luând în considerare cele două mărimi definite anterior, capacitatea și tensiunea teoretică putem defini cu ajutorul acestora energia teoretică ca fiind2:
\[ Watt \; ora [Wh] = Tensiunea [V] \cdot Amper \; ora [Ah]\]
Luând în exemplul anterior al unui element \(Zn-Cl_2\) pentru care s-a obținut un potențial teoretic de \(2,12 [V]\) și o capacitate teoretică de \(0,394 [Ah/g]\) aplicând ecuația anterioară vom obține o energie specifică teoretică:
\[ Energia_{specifica}= 2,12 [V] \cdot 0,394 [Ah/g] = 0,835 [Wh/g]=835 [Wh/kg] \]
Dacă notăm cu \(w\) energia specifică și ținem cont de ecuațiile anterioare putem scrie ecuația energiei teoretice ca fiind:
\[ w = q \cdot \Delta E^0 \]
Astfel, în cazul bateriei plumb-acid unde tensiunea pe element o considerăm a fi de \(2 [V]\) vom obține o energie specifică de:
\[ w = q \cdot \Delta E^0 = 83,5 {{[Ah]} \over {[kg]}} \cdot 2[V] = 167 {[Wh] \over [kg]} \]
Valorile obținute în practică sunt mult mai mici. Masa reală a bateriei cu plumb fiind formată, pe lângă materialul ce alcătuiesc electrozii (anod și catod), de: electrolit, separatori, recipient, borne, etc.
Puterea electrică maximă furnizată de o baterie/element se obține când se atinge jumătate din tensiunea nominală6, altfel spus:
\[ P_m = {{1} \over {2}} \cdot I \cdot U_0 \]
, unde:
\(P_m\) - reprezintă puterea maximă;
\(I\) - exprimă curentul de descărcare;
\(U_0\) - arată tensiunea nominală a bateriei/elementului.
Rata de încărcare-descărcare – C – rate
Pentru a indica rata de descărcare, respectiv încărcare, este folosit așa numita expresie rata C sau în engleză C rate. Acesta se determină cu ajutorul ecuației2:
\[ I = M \cdot C_n \]
, unde:
\(I\) – reprezintă curentul de descărcare/încărcare, în amperi \([A]\);
\(C\) – reprezintă capacitatea declarată, în amperi-oră \([Ah]\);
\(n\) – reprezintă baza de timp, în ore \([h]\), la care a fost declarată capacitatea;
\(M\) – multiplu sub fracții ale lui \(C\).
De exemplu o baterie declarată ca fiind de \(5 [Ah]\) la o rată de descărcare de \(5 [h]\)(\(C_5=5 [Ah]\)) va avea o rată de descărcare pentru \(0,1C_5\) sau \(C_5/10\) de \(0,5 [A]\).
Capacitatea unei baterii la \(1C\) înseamnă că o baterie complet încărcată la \(1 [Ah]\) trebuie să furnizeze \(1 [A]\) pentru o oră, \(1 [h]\). Aceeași baterie care se descarcă la \(0,5C\) ar trebui să ofere \(0,5 [A]\) timp de două ore, \(2 [h]\) , iar la \(2C\) va debita un curent de \(2 [A]\) timp de 30 de minute sau jumătate de oră, \(0,5 [h]\). Pierderile la descărcările rapide reduc timpul de descărcare și tot odată aceste pierderi vor afecta și timpul de încărcare.
Producătorii marchează capacitatea la diferite rate \(C\). În general pentru baterii folosite la tracțiune acestea datorită specificului de lucru de \(8 [h]\), al unui schimb de lucru, sunt cu capacitatea marcată la \(C_5\), iar cele pentru aplicații staționare, în general, sunt date la rate de \(C_{10}\) sau cel mai adesea la \(C_{20}\), din motive de marketing. De aceea va trebui să fim atenți la capacitatea bateriei, în \([Ah]\), la ce rată a lui \(C\) este definită. Cu alte cuvinte o baterie marcată/declarată cu o capacitate de \(100 [Ah]\) la \(C_{10}\) are capacitatea mai mare în comparație cu o baterie marcată/declarată tot de \(100 [Ah]\) dar la \(C_{20}\).
Utilizarea bateriilor
Energia electrică generată de către sistemul de energie regenerabilă, în acest caz fotovoltaic, este necesar a fi stocată într-un sistem de baterii de acumulare. Acest tip de sistem mai poartă denumirea de sistem off grid deoarece sistemul regenerabil de producere a energiei electrice nu are legătură cu Sistemul Electric Național (SEN). Există și sisteme on grid la care sistemul de stocare lipsește, iar în cadrul acestora energia electrică produsă de către sistemul regenerabil de producere a energiei electrice este livrat direct în Sistemul Electric Național (SEN).
Sistemul de stocare folosind baterii de acumulare se pretează a fi folosit atunci când se dorește alimentarea cu energie electrică a echipamentelor, respectiv a dispozitivelor electrice în următoarele cazuri:
- Lipsa unei linii electrice aeriene (LEA) sau a unei electrice subterană (LES) ce face parte din sistemul de distribuție a energiei electrice și fiind conectată la Sistemul Electric Național (SEN), cazul sistemului off grid;
- Obținerea unei tensiuni de alimentare „pur” continue și lipsită de „zgomote”, cazul sistemelor de comunicații. În acest caz sistemul de acumulare poate funcționa atât alimentat dintr-un sistem regenerabil cât și din Sistemul Electric Național;
- Obținerea de cureți mari, respectiv de puteri mari, pentru un timp foarte scurt, cazul echipamentelor sau dispozitivelor electrice ce au nevoie pentru un timp foarte scurt de cureți mari respectiv de puteri mari, întâlnim acest lucru în acționări electrice (electrocare, electrostivuitoare, automobile, etc.). De asemenea acestea mai sunt folosite și atunci când nu este necesar a se contracta putere instalată mare, pentru a acoperi vârfurile de sarcină pe termen scurt, sau în cazul în care nu este disponibil a contracta putere instalată mai mare, de la operatul sistemului de distribuție a energiei electrice, pentru ca acesta în final să fie folosită o perioadă foarte scurtă de timp. Puterea instalată contractată se plătește pentru fiecare oră pe întreaga durată a contractului, în plus este necesar a se dimensiona instalațiile electrice, corespunzător cu puterea instalată necesară, de la punctul de racordare indicat de către operatorul sistemului de distribuție;
- În realizarea de sisteme de backup necesare pentru alimentarea echipamentelor electrice ce sunt necesare a fi alimentate în mod continuu, fără întreruperea energiei electrice, cazul echipamentelor de susținere a vieții, de semnalizare, etc.
Sistemul on grid este folosit în cazul în care sistemul de stocare în baterii de acumulare nu este imperios necesar și evident atunci când dispunem de o linie electrică racordată la un sistem de distribuție. Acest gen de sistem de producere și folosire a energiei electrice prezintă marele avantaj că nu mai este necesar a se investi în sistemul de baterii de acumulare dar implică obligatoriu un aviz de la operatorul sistemului de distribuție/transport cât și de și un program comun de exploatare a liniei electrice respective. De asemenea este necesar ca mijlocul de măsurare folosit în punctul de racord să fie cu dublu sens, respectiv să poată contoriza energia electrică injectată în sistemul energetic cât și cea consumată din sistemul energetic ce poate fi racordat la Sistemul Electric Național (SEN) sau poate fi un sistem de distribuție a energiei electrice închis.
Bateriile de acumulare plumb-acid
Bateriile de acumulare sunt dispozitive alcătuite din unul sau mai multe elemente ce permit acumularea de energie electrică în energie chimică și care în orice moment poate reconverti energia chimică, astfel acumulată, în energie electrică7.

Figura 3. Componentele unui element plumb-acid7
, unde:
\(1\) – bare tubulare ale grilei pozitive, turnate sub presiune;
\(2\) – element de protecție a grilei pozitive cu rezistență ridicată la acid și oxidare;
\(3\) – întăritura tuburilor pozitive;
\(4\) – placa negativă;
\(5\) – separator microporos cu calități izolatoare din punct de vedere electric;
\(6\) – borne alămite turnate în aliaj de plumb;
\(7\) – capac cu filet sau tip baionetă;
\(8\) – bac și capac rezistent la acid. Bacul este transparent și gradat iar capacul este marcat cu polaritatea fiecărei borne.
Principalele componente ale unui element plumb acid
Electrozii (plăcile) pozitivi
Diferențierea bateriilor plumb-acid se realizează prin tehnologia care a stat la baza realizării electrozilor pozitivi ce sunt realizați sub forma de grilă și un material activ.
Astfel întâlnim următoarele tipuri de plăci/electrozi pozitivi7:
- Plăci (electrozi) pozitive de tip Planté:
- Grila și materialul activ sunt unul și același;
- Placa pozitivă este realizată din plumb pur;
- Turnarea plăcii se realizează sub presiune într-o singură piesă;
- Pe fiecare parte sunt numeroase benzi verticale în vederea creșterii suprafeței;
- Materialul activ îl constituie startul de dioxid de plumb ce se formează pe suprafața benzilor verticale.
- Plăci (electrozi) pozitive plane:
- Placa este sub formă de grilă și este realizată din aliaj de plumb;
- Turnarea plăcii se realizează prin turnare gravitațională;
- Placa este compusă dintr-un cadru având formă pătrat sau dreptunghi formată din mai multe bare orizontale și verticale (grilă);
- Materialul activ îl reprezintă o pastă pe bază de oxizi de plumb depusă pe grilă.
- Plăci (electrozi) pozitive tubulare:
- Grilă este realizată din aliaj de plumb;
- Turnarea este realizată prin turnare sub presiune;
- Placa este compusă dintr-un număr de tuburi ce conțin materialul activ iar capătul tuburilor sunt prinse ferm cu ajutorul unei tălpi din polietilenă;
- Materialul activ îl reprezintă o pulbere din dioxid de plumb.
Electrozii (plăcile) negativi
Aceste sunt caracterizate prin7:
- Forma este plată;
- Grila este realizată din aliaj de plumb;
- Turnarea grilei a fost realizată prin tunare gravitațională;
- Grila este compusă dintr-un cadru având formă pătrat sau dreptunghi formată din mai multe bare orizontale și verticale;
- Materialul activ îl reprezintă o pastă din dioxid de plumb ce este depus pe grilă.
Materialul activ
Pentru placa (electrodul) pozitiv avem dioxidul de plumb, de culoare maron (ciocolatie).
Pentru placa (electrodul) negativ avem plumbul spongios de culoare gri (cenușie).
Fasciculul pozitiv sau negativ
Este asocierea plăcilor cu aceeași polaritate7, unde:
- Fiecare placă are o extremitate (coadă);
- Aceste extremități ale plăcilor sunt sudate cu ajutorul unei bare orizontale ce este la rândul ei prinsă cu ajutorul unei bare verticale de borna pozitivă sau negativă.
Grupare (înserierea)
Reprezintă asocierea a două fascicule de polarități diferite, iar plăcile sunt izolate între ele cu ajutorul separatorului7.
Separatoarele
Rolul principal al unui astfel de separator este de a evita scurtcircuitele. Dar, pe lângă acest principal obiectiv, trebuie să mai îndeplinească multe calități și funcții7:
- Trebuie:
- Să evite orice scurtcircuit realizat direct sau indirect între o placă pozitivă și una negativă;
- Să permită trecerea ionilor;
- Să mențină distanța necesară între plăci;
- Să permită difuzarea electrolitului;
- Să permită eliberarea gazelor;
- Să fie neutru din punct de vedere chimic;
- Să prezinte rezistență bună la oxidare și la acid.
Principalele materiale de bază folosite în realizarea acestor separatoare sunt:
- Hârtia sau poliesterul impregnat cu rășină fenolică;
- PVC-ul;
- Polietilena;
- Cauciucul.
Electrolitul
Electrolitul este o soluție de acid sulfuric \(H_2SO_4\), diluat cu apă. Densitatea acestuia variază în funcție de tipul de acumulator și de locația (zona geografică) de utilizare7.
Tabelul 5. Densitatea electrolitului funcție de zona geografică și tipul de element (prod. OLDHAM)
| Tip element | Climat temperat \([g/cm^3\)] | Climat tropical \([g/cm^3]\) |
|---|---|---|
| Plăci pozitive de tip Planté | 1,210 | 1,200 |
| Plăci pozitive plane | 1,250 | 1,240 |
| Plăci pozitive tubulare | 1,265 | 1,250 |
Bacul (recipientul)
Bacul este un recipient realizat dintr-un material electroizolant, care nu poate fi atac de acidul sulfuric și este realizat din ebonită, polipropilenă (PP), Acrilonitril Butadien Stiren (ABS), etc. Acesta are ca scop menținerea grupului de plăci pozitive și negative în electrolit7.
Capacul și bușonul
Capacul este confecționat, de obicei, din același material ca și recipientul (bacul). Capacul, după introducerea plăcilor, este lipit sau sudat de bac iar trecerea terminalelor prin el sunt etanșate cu manșoane din cauciuc. Bușonul, este demontabil, rezistent la acizi, va trebui să permită trecerea gazelor dar nu și a electrolitului7.
Elementul
Reprezintă acumulatorul complet7. Forță electromotoare a unui element este de \(2,1 [V]\). Prin convenție se consideră tensiunea nominală a unui element ca fiind de \(2 [V]\). Există acumulatori monobloc format din 3 elemente, cu tensiunea nominală de \(6 [V]\) și din 6 elemente, cu tensiunea nominală de \(12 [V]\).
Bateria
Reprezintă ansamblul de elemente grupate serie/paralel iar legătura dintre elemente este realizată prin punți sau conexiuni flexibile sau rigide7.
Principiul de funcționare
Descărcarea reprezintă transformarea energiei chimice în energie electrică. Materialele active pozitive și negative se sulfatează prin intermediul electrolitului (soluția de acid sulfuric). Densitatea electrolitului scade în timpul descărcării 7.
Încărcarea reprezintă transformarea energiei electrice în energie chimică. Materialele active și pozitive se de-sulfatează prin intermediul electrolitului. Densitatea electrolitului crește în timpul încărcării până la revenirea la valorile nominale.
Bateria cu plumb-acid folosește dioxidul de plumb, \(PbO_2\), ca material activ al electrodului pozitiv și plumb pur, \(Pb\), într-o structură poroasă, ca material activ al electrodului negativ iar pentru electrolit folosește o soluție de acid sulfuric, \(H_2SO_4\), în concentrație de \(1,28 [g/cm3]\) diluată cu apă2.
În timpul descărcării elementului, la ambii electrozi apare fenomenul de sulfatare, de transformare în sulfat de plumb, \(PbSO_4\). Procesul se inversează la încărcare, elementul se de-sulfatează. Ecuațiile chimice sunt2:
La electrodul negativ:
\[ Pb \rightleftharpoons Pb^{2+}+2e\]
\[ Pb^{2+}+SO_4^{2-} \rightleftharpoons PbSO_4\]
rezultând:
\[ Pb+SO_4^{2-} \rightleftharpoons PbSO_4+2e\]
La polul pozitiv:
\[ PbO_2+4H^++2e \rightleftharpoons Pb^{2+}+2H_2O\]
\[ Pb^{2+}+SO_4^{2-} \rightleftharpoons PbSO_4\]
rezultând:
\[ PbO_2+4H^++SO_4^{2-}+2e \rightleftharpoons PbSO_4+2H_2O\]
Reacția electrochimică globală este suma celor două ecuații rezultate la fiecare electrod:
\[ Pb+PbO_2+2H_2 SO_4 \rightleftharpoons 2PbSO_4+2H_2O\]
În timpul încărcării, pe măsură ce elementul se apropie de încărcare completă și majoritatea sulfatului de plumb, \(PbSO_4\), a fost transformat în plumb, \(Pb\), sau dioxid de plumb, \(PbO_2\), tensiunea celulei la încărcare devine mai mare decât tensiunea de gazare (aproximativ \(2,39 [V]\)) și vor apare reacțiile de suprasarcină, ceea ce va duce la producerea de hidrogen și respectiv oxigen (gaze) și va rezulta o pierdere de apă din electrolit2.
Reacțiile, în cazul depășirii tensiunii de încărcare de \(2,39 [V]\) per element, fiind:
la electrodul negativ:
\[ 2H^++2e \longrightarrow H_2\]
la electrodul pozitiv:
\[ H_2 O-2e \longrightarrow {{1}/{2}} \; O_2+2H^+\]
rezultând:
\[ H_2 O \longrightarrow H_2+1/2 \; O_2 \]
În elementele plumb-acid etanșe, această reacție este controlată pentru a minimiza pierderea apei, prin recombinarea oxigenului rezultat la electrodul negativ. Elementul este astfel proiectat încât oxigenul rezultat, \(1/2 \; O_2\), să difuzeze la electrodul negativ, din \(Pb\), unde va forma oxidul de plumb, \(PbO\), ce va interacționa cu acidul sulfuric, \(H_2SO_4\), reacție în urma căreia va rezulta sulfatul de plumb \(PbSO_4\) și apă, \(H_2O\)2.
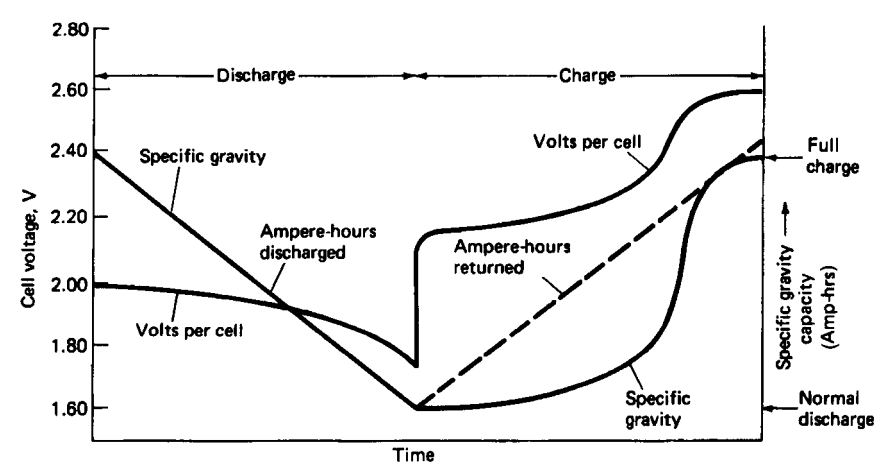
Figura 4. Tensiunea și densitatea specifică a bateriei plumb-acid la o rată de descărcare/încărcare constantă2
Modificarea volumului materialelor active
Porozitatea și volumul materialelor active se schimbă în timpul reacțiilor chimice. Porozitatea este maximă atunci când acumulatorul este încărcat. Prezența porilor în materialele active este necesară7:
- Astfel încât electrozii să fie permeabili la electrolit;
- Să facă posibil alternarea sulfatării și de-sulfatării, fără a se distruge structura. Pentru electrodul pozitiv, transformarea dioxidului de plumb \(PbO_2\), în suflat de plumb, \(PbSO_4\), este însoțită de o modificare a volumului cu 83[%].
Pentru electrodul negativ, transformarea plumbului spongios, \(Pb\), în sulfat de plumb, \(PbSO_4\), este însoțită de o modificare a volumului cu 165[%].
Având în vedere aceste mari variații de volum ale materialelor active și dacă materialele active ar fi utilizate complet vor rezulta distrugeri iremediabile ale electrozilor. În acest scop masa activă este utilizată numai 30[%] iar acest lucru se realizează prin limitarea descărcării la o tensiune denumită tensiune de oprire7.
Forța electromotoare – tensiunea în gol
Forța electromotoare sau tensiunea în gol reprezintă diferența algebrică între potențialul plăcii pozitive și potențialul plăcii negative. Aceste tensiuni pot fi măsurate, în laborator, folosind un electrod de: cadmiu sau sulfat de mercur. Diferența dintre aceste două potențiale dă forța electromotoare7.
Tabelul 3 6. Tabelul tensiunilor7
| Placa pozitivă | Placa negativă | Tensiunea pe element | |
|---|---|---|---|
| [V] | [V] | [V] | |
| În descărcare | 1,9 | 0,2 | 1,7 |
| În repaus | 2,21 | 0,11 | 2,1 |
| În floating (încărcare) | 2,3 | 0,1 | 2,2 |
| La sfârșitul încărcării \(0,03C_{10}\) | 2,4 | -0,3 | 2,7 |
Tensiunea nominală a unui element plumb-acid este de \(2[V]\), tensiunea în gol fiind o funcție directă a concentrației de electrolit. Astfel această variază de la \(2,125[V]\), pentru un element cu electrolitul având densitatea specifica de \(1,28[g/cm^3]\), până la \(2,05[V]\), pentru un element cu \(1,21[g/cm^3]\) densitate specifică. Tensiunea de oprire a descărcării, cu rată moderată, este de \(1,75[V]\) pe element, dar poate coborî până la \(1[V]\) per element, la o rată extrem de ridicată a descărcării și la temperaturi scăzute, lucru de preferat a fi de evitat2.
Tensiunea la borne se definește astfel7:
-
În timp ce se încarcă, tensiunea variază între \(2,1[V] – 2,8[V]\):
\[ U=E+R \cdot I\]
-
În timp ce se descarcă, tensiunea variază între \(2,1[V] – 1,7[V]\):
\[ U=E-R \cdot I\]
, unde:
\(U\) – reprezintă tensiunea la borne, în \([V]\);
\(E\) – reprezintă forța electromotoare, în \([V]\);
\(R\) – reprezintă rezistența internă a elementului, în \([Ω]\);
\(I\) – reprezintă curentul prin element, în \([A]\).
Autodescărcarea
Reprezintă fenomenul natural datorat reacțiilor de oxidare și de reducere ce apare spontan atât la electrozii pozitivi cât și la cei negativi7.
-
La electrodul pozitiv:
\[ PbO_2+H_2SO_4 \longrightarrow PbSO_4+H_2 O +1/2 \; O_2 \]
-
La electrodul negativ:
\[ Pb+H_2SO_4 \longrightarrow PbSO_4+H_2\]
\[ Pb+1/2\;O_2+H_2SO_4 \longrightarrow PbSO_4+H_2O\]
Autodescărcarea poate avea valori ridicate și ca urmare a altor factori, cum ar fi reacțiile interne la nivelul materialelor active unde apare un fenomen de micropile, datorate diferenței de potențial cu plumbul activ al plăcilor și impurităților metalice7:
- Prezente în materialele de bază;
- Provenite din completările cu apă nu tocmai potrivită sau imperfect demineralizată/distilată;
- Provenite de la îmbătrânirea naturală sau accelerată a bateriei.
În general, autodescărcarea va depinde de7:
- Cuplul electrochimic;
- Natura materialelor utilizate în construcție;
- Datorită proiectării (concepției utilizate);
- Temperatura ambientală;
- Solicitarea în timpul utilizării;
- Numărul de încărcări și descărcări;
- Mentenanței.
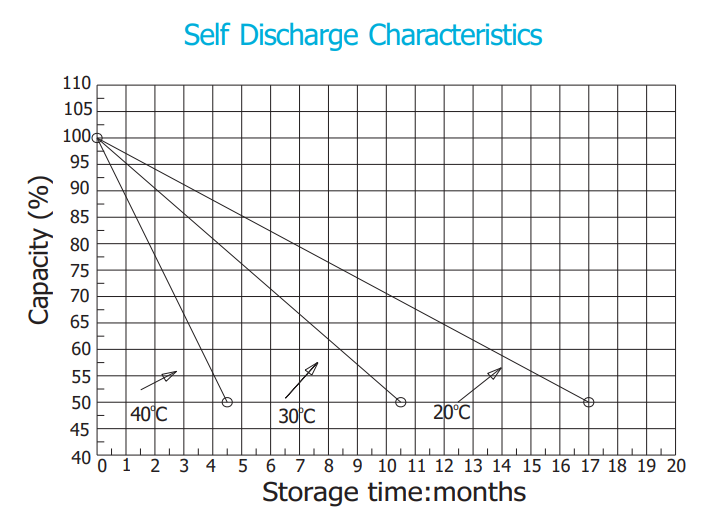
Figura 5. Autodescărcarea - Influența temperaturii - Baterie BSB Solar 12-2008
Tensiunea de floating – de menținere
Reprezintă valoarea determinată a tensiunii astfel încât curentul care trece în baterie este ușor în exces în comparație cu curentul de consum intern al bateriei datorat autodescărcării7.
Toate bateriile cu plumb-acid, indiferent de fabricant, indiferent de principiul constructiv, indiferent de natura materialelor folosite, au aceeași tensiune de floating.
Tabelul 7. Tensiunile de floating pe element7
| Plumb deschise | 2,20 [V] | Temp.: \(20 – 25^0C\) |
| Plumb etanșe | 2,25 [V] | Temp.: \(20 – 25^0C\) |
Având în vedere că tensiunea la borne depinde de temperatura se efectuează o corecție pentru temperaturile peste \(25[^0C]\) si sub \(20[^0C]\)7:
- Temperaturile sub \(20[^0C]\) corecția necesară este de \(+3[mV/K]\);
- Temperaturile peste \(25[^0C]\) corecția necesară este de \(-3[mV/K]\);
După cum am văzut un element se află în floating atunci când acesta este în procesul de încărcare iar tensiunea depășește cu puțin tensiunea în gol astfel încât să fie acoperite pierderile datorate descărcării. Valoarea curentului de floating va depinde de tehnologie, dar în special de temperatură și de densitatea electrolitului, deoarece concentrația de acid sulfuric, \(H_2SO_4\), crește tensiunea celor doi electrozi, cel pozitiv și cel negativ2.
Astfel spus tensiunea electromotoare, având bornele în gol, variază în funcție de concentrația de acid. O creștere a concentrației de acid sulfuric, \(H_2SO_4\), de la 6[%] la 16[%] va crește potențialul electrodului pozitiv cu \(0,06[V]\) iar pe cel negativ cu \(0,004[V]\) ce reprezintă o creștere pe element de \(0,064[V]\)7.
Tabelul 8. Tensiunea (forța) electromotoare în funcție de concentrația acidului sulfuric7
| Densitatea, la \(25^0C\) | Concentrația acidului, \(H_2SO_4\) | Tensiunea electromotoare |
|---|---|---|
| \([g/cm^3]\) | [%] | \([V]\) |
| 1,040 | 6,04 | 1,89 |
| 1,100 | 14,72 | 1,96 |
| 1,150 | 21,38 | 2,00 |
| 1,200 | 27,68 | 2,05 |
| 1,250 | 33,80 | 2,10 |
| 1,280 | 37.40 | 2,13 |
| 1,300 | 39,70 | 2,15 |
Încărcarea și descărcarea bateriilor plumb-acid
O încărcare corectă va avea ca rezultat prelungirea vieții la oricare baterie plumb-acid. Pentru a se realiza acest deziderat pentru bateriile plumb-acid la încărcarea acestora se va ține cont de următoarele trei reguli7:
- Curentul de încărcare, la începutul încărcării, poate avea orice valoare care nu va produce o creștere a tensiunii pe element mai mare de tensiune de apariție a gazelor (de aproximativ \(2,4[V]\));
- Pe toată durata încărcării și până la finalizarea reîncărcării , curentul de încărcare va fi monitorizat și controlat astfel încât tensiunea pe element să fie mai mică ca tensiunea de apariție a gazelor. Pentru o încărcare rapidă se poate folosi o intensitate a curentului chiar sub această tensiune de apariție a gazelor. O tensiune de aproximativ \(2,35[V]\) pe element este considerată sigură;
- Când a avut loc finalizarea reîncărcării, bateria a recăpătat foarte aproape de 100[%] din capacitatea ei nominală, curentul de încărcare va fi finalizat și limitat la \(C_{20}\) (de exemplu \(10[A]\) pentru o baterie cu o capacitate de \(200[Ah]\)). După finalizare se va micșora curentul de încărcare astfel încât tensiunea pe element să fie de egală cu tensiunea de floating (de menținere).
Principiul de încărcare
În timpul încărcării, au loc următoarele fenomene7:
- Electrozii vor reface acidul sulfuric prin de-sulfatare;
- Tensiunea (forța) electromotoare va crește;
- Rezistența internă va scade ca urmare a creșterii concentrației în electrozi;
- Când tensiunea pe element atinge \(2,35[V]\) va începe apariția de gaz la acei doi electrozi;
- Tensiunea electrodului negativ va schimba semnul la sfârșitul încărcării astfel încât aceasta se va adăuga la tensiunea pozitivă. Aceasta schimbare de sens face ca tensiunea pe element să crească brusc;
- Faptul că vor deveni nominale și constante tensiunea la borne, densitatea electrolitului și vor apărea degajări de gaze acestea sunt indicii că a apărut sfârșitul reîncărcării;
- Continuarea încărcării va deveni o suprasarcină pentru baterie și va face ca întregul curent să fie utilizat pentru descompunerea apei în hidrogen și oxigen.
Încărcarea la curent constant
Datorita faptului că încărcare presupune controlul curentului acest tip de încărcare nu este utilizată la încărcarea bateriilor cu plumb-acid. Această metoda este folosită numai când se folosesc curenți mici pentru încărcare, evident cu creșterea semnificativă a duratei de încărcare la 12 ore sau mai mult. Intensitatea curentului este limitată la \(0,03C_{10}\) iar încărcarea se întrerupe când temperatura pe element atinge \(40[^0C]\)2 7.
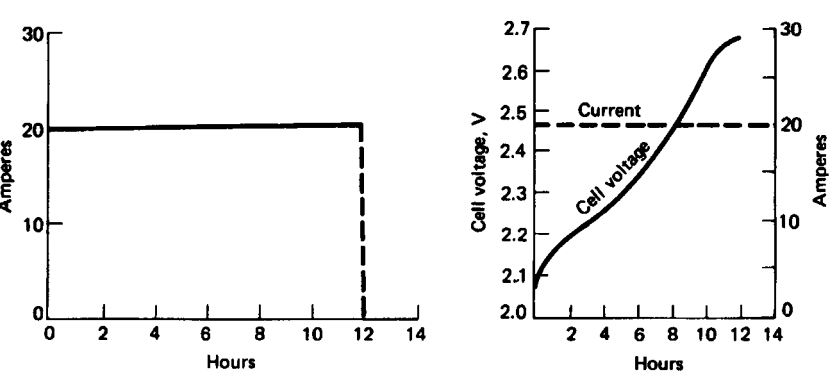
Figura 6. Încărcarea la curent constant2
Încărcarea la tensiune constantă
Această metodă de încărcare este cea mai utilizată metodă atât pentru bateriile plumb-acid staționare cât și pentru bateriile plumb-acid de tracțiune. În figura de mai jos este prezentată caracteristicile curbelor de curent și tensiune la încărcarea la tensiune constantă:
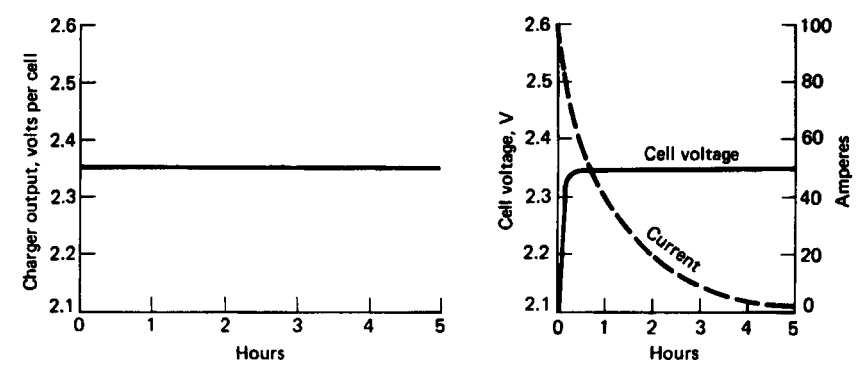
Figura 7. Încărcarea la tensiune constantă2
Și în acest caz circuitul de încărcare prezintă un sistem de limitare a curentului de încărcare limitat la \(0,1C_{10}\)2.
Tensiunea constantă de încărcare reprezintă o tensiune mai mare ca cea de floating cuprinsă între \(2,25[V]\) și \(2,35[V]\) pe element. De asemenea și în acest caz vom urmări a nu se depăși tensiunea apariție a gazelor de aproximativ \(2,4[V]\) pe element astfel că dispozitivul de încărcare va avea limita de tensiune la \(2,39[V]\) sau va decupla automat la apariția acestei tensiuni pe element2 7.
Încărcarea în impulsuri (pulse charging)
Acest tip de încărcare este folosită pentru bateriile plumb-acid utilizate la tracțiune dar și în cazul celor staționare folosite împreună cu panouri solare. În cazul acestui tip de încărcare are loc decuplarea pentru o perioadă a încărcătorului de pe baterie, timp în care se măsoară la gol tensiunea pe baterie/element. Având in vedere acest aspect, decuplarea sursei de pe sarcină, acest gen de încărcare nu se folosește în cazul generatoarelor eoliene unde este interzis a lăsa a merge în gol generatorul eolian2.
Principial acest tip de încărcare se oprește când tensiunea măsurată per element la gol este mai mare de un anumit prag setat.
Încărcare lentă (trickle charging)
O încărcare lentă este practic o încărcare la curent constant, cu o rață scăzută de aproximativ \(C/100\), ce este utilizată pentru a menține bateria în stare încărcată. Este folosită de asemeni, la restabilirea capacității, în cazul folosirii bateriilor în mod intermitent2 .
Încărcarea rapidă
În unele aplicații este necesar a se realiza o restabilirii a capacității nominale într-un timp foarte scurt (o oră sau mai puțin), lucru întâlnit de obicei la bateriile plumb-acid folosite la tracțiune (de exemplu la submarine). Pentru evitarea distrugerii iremediabile a bateriei circuitul de încărcare monitorizează foarte atent: temperatura și tensiunea pe element și va controla astfel rata de reîncărcare respectiv viteza de încărcare, la maximum posibil, prin limitarea supraîncărcării respectiv apariția gazelor2.
Descărcarea
În timpul descărcării densitatea electrolitului va scade progresiv, prin difuzarea acidului la electrozi care vor sulfata iar rezistența internă va crește. Variația tensiunii pe element este de aproximativ 0,3[V] iar tensiunea electromotoare va scade cu atât mai rapid cu cât intensitatea de descărcare este mai mare7.
Astfel dacă ne uităm în foia de catalog a bateriei BSB Solar 12-200 vom constata că aceeași bateriei este marcată la diferite rate \(C\) în funcție de curentul de descărcare și de asemenea în funcție de adâncimea de descărcare (DOD – Depth of Discharge) vor depinde numărul de cicluri a fi posibile de reîncărcare8.
Tabelul 9. Capacitatea unei baterii BSB Solar 12-200 funcție de curentul de descărcare8
| Timpul [h] | 1 | 3 | 5 | 10 | 24 | 48 | 72 | 100 | 120 |
| Tens. finală [V] | 1,8 | 1,8 | 1,8 | 1,8 | 1,8 | 1,8 | 1,8 | 1,8 | 1,8 |
| Capacitatea [Ah] | 130 | 150 | 171 | 200 | 214 | 224 | 233 | 240 | 243 |
După cum observăm din tabel aceeași baterie BSB 12-200 ce este marcată și comercializată de producător la \(C_{10}\) ca fiind de \(200[Ah]\) va avea o capacitate la \(1C\) de numai \(130[Ah]\) iar la \(C_{120}\) capacitatea acesteia va crește la \(243[Ah]\).
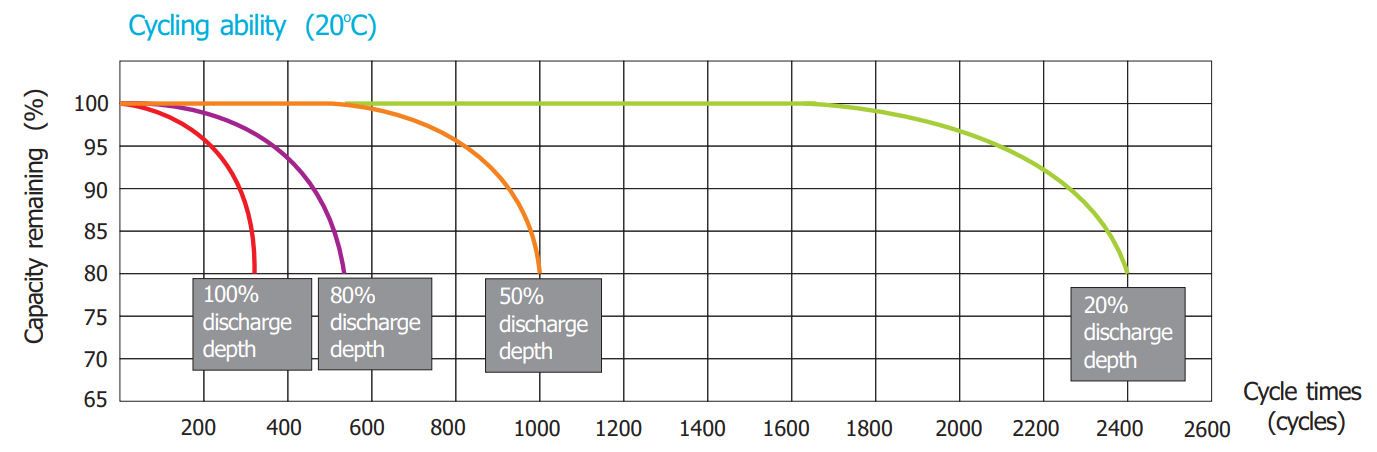
Figura 8. . Numărul de cicluri posibile vs DOD la bateria BSB Solar 12-2008
Din figura de mai sus observăm că în cazul unei baterii viața acesteia, ce se traduce prin numărul posibil de încărcări-descărcări, scade dramatic odată cu creșterea adâncimii de descărcare (preluarea unei mari cantități de energie din baterie). Astfel în cazul unor descărcări de 100[%] bateria noastră va avea numai 300 de cicluri iar în cazul unor descărcări de aproximativ 20[%] numărul de cicluri va crește considerabil la 2400 de cicluri De acest lucru se va ține seama în proiectarea unui sistem cu baterii plumb acid și se va avea în vedere un procent de 70[%]-80[%] al DOD.
O baterie se consideră că și-a atins durata de viață când capacitatea acesteia a ajuns 80[%] din capacitatea inițială la un ciclu complet de reîncărcare9.
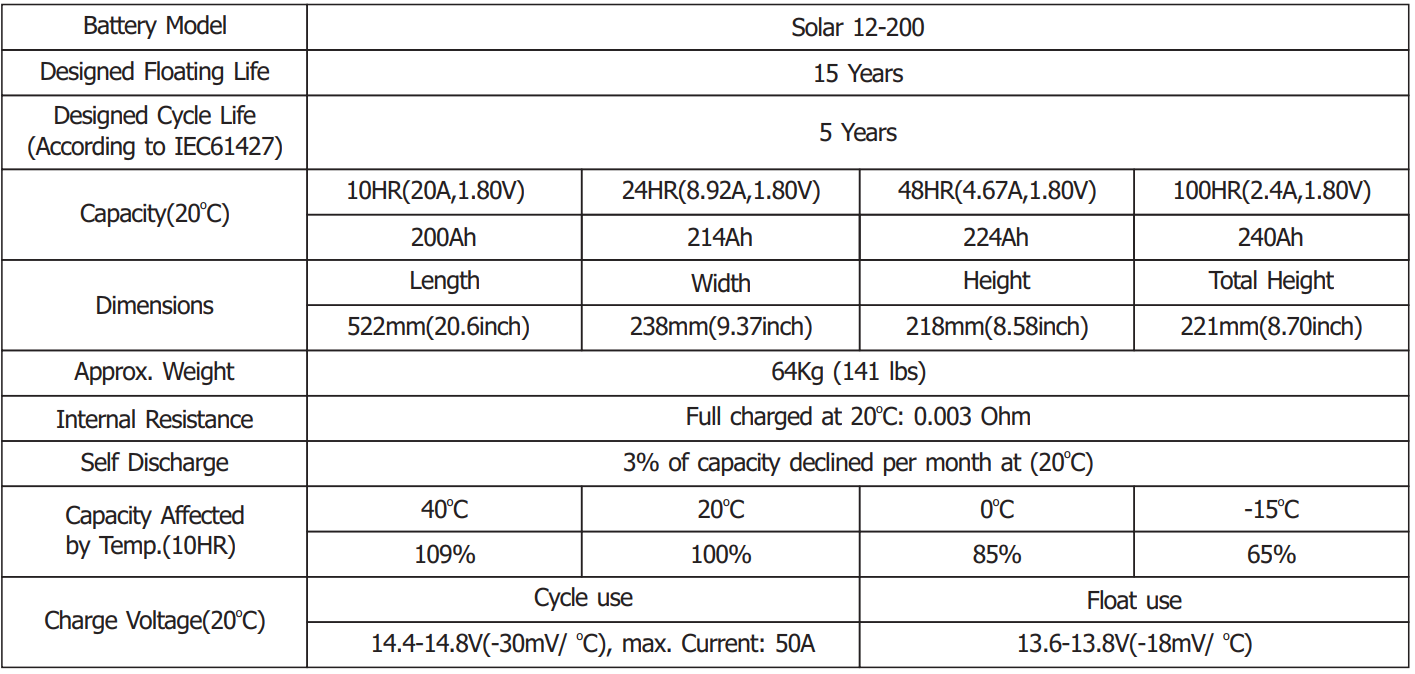
Figura 9. Principalele caracteristici a bateriei BSB Solar 12-200
În figura de mai sus sunt prezentate principalele caracteristici, prezentate în foia de catalog, ale bateriei BSB Solar 12-200.
Din acesta putem afla că:
- Denumirea modelului Solar 12-200;
- Durata de viață a bateriei menținută în regim de floating – complet încărcată și la care pierderile datorate autodescărcării sunt recuperate cu un încărcător – durata de 15[ani];
- Durata de funcționare în regim funcționare – 5[ani] – ceea ce reprezintă pentru o baterie \(C_{10}\) la un ciclu complet la \(24[h]\) un număr de aproximativ \(1800\) de cicluri. De unde rezultă că vom obține aceste caracteristici pentru un DOD de aproximativ 70[%];
- Capacitatea aferentă, la \(20[^0C]\), pentru diferite rate \(C\) ale descărcării;
- Dimensiunile, de \(522[mm]x238[mm]x218[mm]\);
- Greutatea, de \(64[kg]\);
- Rezistența internă când acesta este încărcată, la \(20[^0C]\), \(3[mΩ]\);
- Autodescărcarea, în [%], pentru fiecare lună, la \(20[^0C]\), de 3[%/lună];
- Capacitatea la \(C_{10}\) afectată de temperatură;
- Tensiunea de încărcare, în \([V]\), pentru ciclurile de funcționare \(14,4[V]-14,8[V]\) la un curent de maxim \(50[A]\) și în floating de \(13,6[V]-13,8[V]\).
Curentul maxim este curentul de scurtcircuit pe element, se determină cu ajutorul rezistenței interne:
\[ I_{sc} = {{U} \over {R}} ={{2,1}\over {({0,003}/6)}} {{[V]} \over {[\Omega]}} = 4200 [A] \]
, unde:
\(I_{sc}\) – reprezintă curentul de scurtcircuit, în \([A]\);
\(U\) – reprezintă tensiunea pe element, în \([V]\);
\(R\) – rezistența internă a unui element, în \([Ω]\).
Dimensionarea bateriilor
Dimensionarea unui sistem (string) de baterii se face ținând seama de caracteristica consumatorului7.
Dimensionarea în regim de curent constant
Datele proiectării sunt:
Tabelul 10 Datele cunoscute pentru proiectare
| Puterea - P | 2,5 | \([kW]\) |
| Tensiunea minimă - Umin | 43 | \([V]\) |
| Tensiunea maximă - Umax | 54 | \([V]\) |
| Autonomie | 10,0 | \([h]\) |
| Temperatura | 20,0 | \([^0C]\) |
Determinarea numărului maxim de elemente necesare se va face ținând cont de tensiunea maximă necesară și de tensiunea per element când acesta este încărcat7:
\[ N_{el} = {{U_{max}} \over U_{el_{inc}}} = {{54} \over {2,25}} = 24 \]
Tensiunea minima pe element se determina pentru cazul cel mai defavorabil atunci când bateria a atins tensiunea minimă raportat la numărul de elemente determinat anterior7:
\[ U_{el(min)} = {U_{min} \over N_{el}} = {{43}\;[V] \over {24}} \cong 1,8 [V]\]
Determinarea curentului maxim ce va fi solicitat din baterie se va face ținând cont de cazul cel mai defavorabil pe care îl întâlnim atunci când tensiunea este minimă, astfel încât să putem asigura puterea nominală sarcinii7:
\[ I_{desc} = {{P} \over {U_{min}}} = {{2500} \over {43}} {{[W]} \over {[V]}} = 58,14 [A] \]
Din datele rezultate va trebui să realizăm o baterie formată din \(24\) elemente ce vor trebui să asigure \(58,14 [A]\) timp de \(10 [h]\), iar la finalul acestor ore, tensiunea pe element să nu fi mai mica de \(1,8 [V]\).
Cu datele anterioare și din analiza ofertelor m-am oprit la elementul de tip OPzV2-60010 care asigură un curent de \(58,8 [A]\) timp de \(10 [h]\) iar tensiunea la finalul acestor ore este de \(1,83 [V]\). Un astfel de element ar avea un cost destul de însemnat.
În cazul în care avem consumatori ce au și vârfuri de curent de scurtă durată se va suplimenta bateria noastră, de preferat cu baterii de tip CapBat (baterii de condensatori) deoarece acestea prezintă pe lângă avantajul multitudinilor de cicluri, chiar la descărcări complete, și faptul că sunt în stare a debita o mare cantitate de curent în foarte scurt timp, deoarece, în acest caz, energia este stocată direct în sarcini electrice.
-
„Electric battery,” [Interactiv]. Available: https://en.wikipedia.org/wiki/Electric_batter ↩
-
D. Linden și T. B. Reddy, "Handbook of batteries" - Third Edition, McGraw-Hill, 2002 ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩
-
„Daniell cell,” [Interactiv]. Available: https://en.wikipedia.org/wiki/Daniell_cell ↩
-
D. Linden, „Basic concepts,” în "Handbook of batteries" - Third Edition, McGraw-Hill, 2002 ↩
-
„BU-209: How does a Supercapacitor Work?,” [Interactiv]. Available: https://batteryuniversity.com/learn/article/whats_the_role_of_the_supercapacitor ↩
-
P. Kurzweil și O. K. Dietlmeier, Elektrochemische Speicher - Superkondensatoren, Batterien, Elektrolyse-Wasserstoff, Rechtliche Rahmenbedingungen, Springer, 2018 ↩ ↩
-
Lenain, Pierre; Legrand, Nathalie; OLDAHM France SA, Informations sur l'accumulateur au plomb, Oldham France SA, 1992 ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩
-
„https://www.caranda.ro/,” [Interactiv]. Available: https://www.caranda.ro/wp-content/uploads/2015/07/Solar12-200.pdf ↩ ↩ ↩ ↩
-
„BU-801b: How to Define Battery Life,” [Interactiv]. Available: https://batteryuniversity.com/learn/article/how_to_define_battery_life ↩
-
„OPzV2-600,” Caranda, [Interactiv]. Available: https://www.caranda.ro/product/opzv2-600/ ↩